Nature Communications | 上海交大白林泉团队解析新颖二聚化氨甲酰基转移酶晶体结构及催化机制
近日,上海交通大学生命科学技术学院白林泉教授团队在国际权威期刊《Nature Communications》上在线发表了题为“Endowing homodimeric carbamoyltransferase GdmN with iterative functions through structural characterization and mechanistic studies”的研究论文。该研究聚焦安莎类药物(安丝菌素和格尔登素)生物合成后修饰中新颖二聚化氨甲酰基转移酶,细致解析了其蛋白的催化机制,实现了对酶功能的迭代氨甲酰化重塑。生命科学技术学院博士研究生韦建华和厦门大学张璇博士为论文第一作者,生命科学技术学院白林泉教授和康前进副研究员为共同通讯作者。
美登素类药物化学结构上属于安莎类天然产物,具有极强的抗肿瘤活性,现已被成功用于抗体偶联药物的“弹头”分子,开发了治疗HER2+乳腺癌的药物。同时,已有多个管线的抗体偶联药物正处于开发或临床检定阶段。白林泉教授联合多个研究小组,长期研究微生物源美登素类(安丝菌素)药物的生物合成机制和代谢途径改造,并取得了一系列研究成果。
氨甲酰基转移酶作为一类广泛存在于初级代谢和次级代谢的生物大分子,在安莎类药物生物合成后修饰中起到重要作用。次级代谢产物的构效关系研究表明,由氨甲酰基转移酶加载的氨甲酰基对次级代谢产物的生物活性至关重要。该研究发现安莎类氨甲酰基转移酶GdmN以面对面的形式形成了二聚化的结构,特殊的C端结构域通过四个反向β片层的相互作用实现了蛋白二聚化的功能;通过对底物与蛋白复合体的共结晶条件优化,捕获了GdmN与多个反应中间体的复合物晶体,精细展现了供体底物分子与受体底物分子在酶反应中的动态过程和关键氨基酸残基His27和Tyr82,并结合计算分析深入解析了氨甲酰基的转移机制。
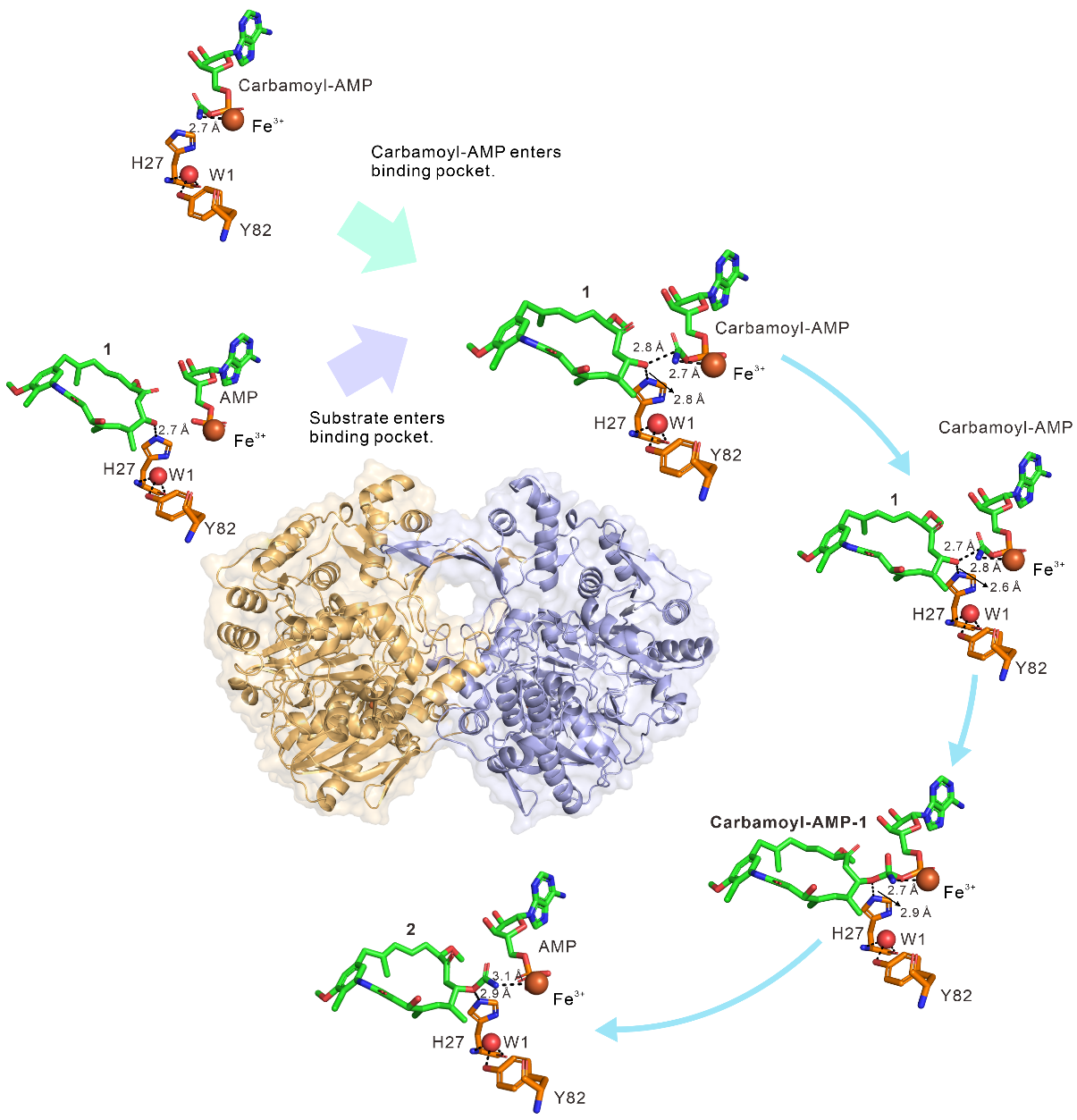
图1.二聚化氨甲酰基转移酶的晶体结构及催化机制
在此基础上,结合蛋白结构和系统发育分析,探讨了二聚化氨甲酰基转移酶的底物识别特征,成功重塑了具有迭代氨甲酰化功能的蛋白,并揭示了蛋白功能重塑前后底物识别位置的变化。
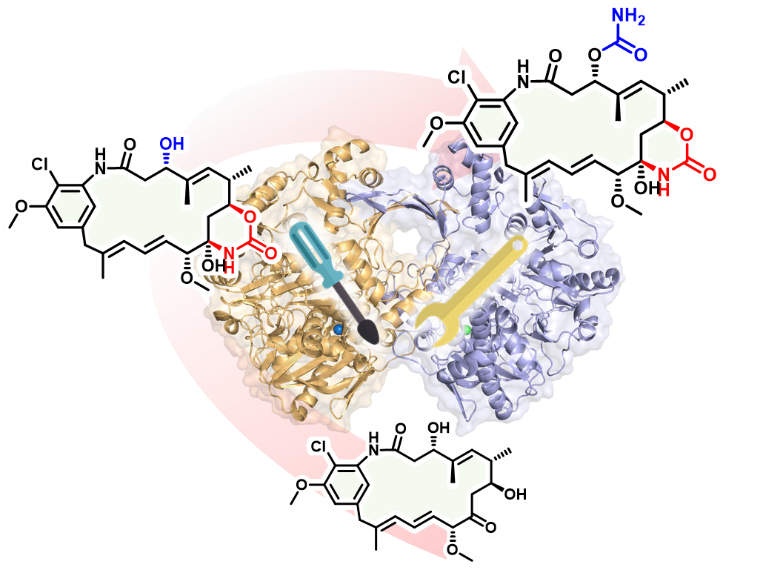
图2. 氨甲酰基转移酶晶体结构指导的功能塑造
该研究解析了二聚化氨甲酰基转移酶蛋白结构,进一步丰富了氨甲酰基转移酶家族蛋白的研究,灵活运用结构生物学手段,捕获到了酶催化过程中多个反应中间体的snapshots,结合计算生物学和蛋白改造,成功重新设计活性位点并扩大其催化能力,为其他蛋白的理性改造提供了借鉴。
该工作得到了我室郑舰艇研究员、唐满成副教授、林芝博士、厦门大学王斌举教授和中科院深圳先进技术研究院周佳海研究员等团队的大力支持。该工作还得到了国家重点研发计划项目、国家自然科学基金和上海市科学技术委员会项目等资助。
论文链接: